yogabuch / bewegungsphysiologie / knochen
Knochen sind die zug- und druckfesten Bestandteile des Endoskeletts der Wirbeltiere. Akzessorische Knochen liegen außerhalb des Bewegungsapparates vor wie etwa die Gehörknöchelchen. Die Knochen des Bewegungsapparates gehören zu dessen passivem Teil. Knochen können schützende Funktion haben wie die Rippen (etwa für Herz und Lunge) oder der Schädel fürs Gehirn. Im den Teilen der Knochen mit roten Knochenmark werden Erythrozyten (rote Blutkörperchen), Leukozyten (weiße) und Thrombozyten (Blutplättchen) gebildet.
Knochen können sehr verschiedene Längen und Formen haben, siehe z.B. Femur, Sesambeine und Scapula.
Man unterteilt die Knochen in
- Röhrenknochen (Ossa longa), z.B. die langen Knochen der Extremitäten wie Femur, Tibia, Fibula, Humerus, Radius, Ulna). Diese bestehen aus einem Knochenschaft (Diaphyse) zwischen zwei Epiphysen (Wachstumszonen), hinter denen die Metaphysen liegen, häufig mit Condylen oder Tuberkeln.
- platte Knochen (Ossa plana) wie Scapula, Sternum, die Knochen des Beckens (Sitzbein, Darmbein, Schambein), Rippen, Schädelknochen
- kurze Knochen (Ossa brevia) ohne besondere Form wie sie als Handwurzelknochen und Fußwurzelknochen vorkommen
- Sesambeine (Ossa sesamoidea), dazu wird auch die Patella gezählt
- unregelmäßige Knochen wie etwa die Wirbel und der Unterkieferknochen (Mandibula)
- einige Knochen (Ossa pneumatica) werden trotz ihrer Form nicht zu den platten Knochen gerechnet, da sie mit Schleimhaut ausgekleidete Hohlräume umgeben, etwa das Os frontale
Knochen sind lebende, gut durchblutete Organe. Sie sind in der Regel außen von Knochenhaut umgeben, außer in den Bereichen, wo sie mit anderen Knochen artikulieren, dort sind sie mit hyalinem Knorpel überzogen. Unter der Knochenhaut liegt die Corticalis, welche in der Diaphyse der Röhrenknochen sehr dicht und fest ist und deswegen als Compacta bezeichnet wird. Profunder als die Corticalis/Compacta liegt die in ihrem Aufbau, nicht aber in ihrer Konsistenz schwammartige Spongiosa, ein Gerüst feiner Knochenbälkchen (Trabekel), die hauptsächlich die Stabilität des Knochens bestimmt, indem sie entsprechend ihrer Ausrichtung Zug- und Druckkräfte aufnehmen.
Im Inneren der Spongiosa liegt die Markhöhle, ein mit Knochenmark gefüllter Raum. In vielen Knochen wird das Knochenmark im Laufe des Lebens zu gelbem Fettmark umgebaut, nur in einigen Knochen bleibt das blutzellenbildende (Hämatopoese) rote Mark erhalten: Rippen, Sternum, Wirbelkörper, Hand– und Fußwurzelknochen, platte Schädelknochen und die Knochen des Hüftbeins.
Neben 25% Wasser besteht der Knochen aus 45% anorganischem Material und 30% organischem, davon 95% Kollagen Typ 1.
Knochen können einem größeren Maß an Zug- und Druckbelastung standhalten, in einem gewissen Maß sind sie auch biegeflexibel.Die Biegebelastungen werden teils durch Zuggurtungen aufgefangen, die aus Bändern, Muskeln und Faszien bestehen, die bekannteste davon ist der Tractus iliotibialis als Zuggurtung für den Femur. Versagt die Zuggurtung oder wird sie beschädigt, kann es zu Spontanfrakturen kommen.
Inhaltsverzeichnis
- 1 Modelling und Remoddeling
- 2 Knochenadaption
- 3 osteoanabol
- 4 Condylus
- 5 Epicondylus
- 6 Tuberkel
- 7 Apophyse
- 8 Diaphyse
- 9 Epiphyse / Epiphysis ossis
- 10 Epiphysenfuge / Wachstumsfuge
- 11 Metaphyse
- 12 Knochenhaut (Periost)
- 13 Spongiosa
- 14 Corticalis
- 15 Röhrenknochen
- 16 Trabekel
- 17 Knochenmark
- 18 Markhöhle /Markraum
- 19 Osteoklasten
- 20 Osteoblasten
- 21 Osteozyten
- 22 Knochendichte
- 23 Kallus
- 24 Frakturheilung
- 25 Osteolyse
- 26 Traktionsapophysitis
- 27 Epiphysiolysis
- 28 aseptische Knochennekrose
- 29 Exostose
- 30 Osteophyt
Modelling und Remoddeling
Bei Knochen wird von Remodeling gesprochen, wenn der Auf- und Abbau von Knochen eine ausgeglichene oder negative Nettobilanz aufweist, ansonsten wird der Begriff Modeling oder Modellierung benutzt. Das Remodeling geschieht wie folgt in Einheiten, Units genannt: Osteoklasten fressen binnen etwa zwei Wochen einen oberflächlichen Tunnel in den Knochen, Howship-Lacune genannt. Wenn die Grube tief genug ist, senden sie Signale an die Osteozyten, die sich daraufhin zu Osteoblasten differenzieren, in die Grube einwandern und proliferieren. Sie bauen in die Grube ein Skelett aus Grundsubstanz ein, das dann mit kollagenen Fasern gefüllt wird. Dieser Prozess dauert etwa 3 bis 4 Monate. Danach werden Mineralien eingelagert, was nochmals sechs bis zwölf Monate dauert. Am Ende hat sich der Osteoblast vollständig in die Knochensubstanz eingebaut und wird wieder zum ruhenden Osteozyten. Diese Beschreibung trifft auf die Kortikalis zu, die trabekuläre Spongiosa ist mit einem etwa viermal so hohen Turnover wesentlich schneller. Auch beim Knochen sind es Transmembranproteine, die Integrine, die Signale an den Osteozyten melden. Bei mechanischen Reizen wird Flüssigkeit von der komprimierten oder gestauchten Seite des Knochens auf die gedehnte verlagert, was zu einem piezoelektrischen Effekt führt. Auch in diesem Prozess spielen Proteine, Enzyme und der Wachstumsfaktor IGF eine Rolle. Wird der Knochen überschwellig belastet, entfernen die Osteoklasten zerstörte Zellen und zerstörte Matrix-Moleküle, um dann einen Ersatz zu initiieren. Vom Remodelling unterschieden werden muss das Modeling, oder die Modellierung: wiederholte überschwellige mechanische Reize führen unmittelbar zur Osteoidsynthese der oberflächlichen Osteoblasten, was zu einer Zunahme des Knochendurchmessers führt. Unter präpubertären Sportlern wiesen Turner et al. die höchste Knochendichte auf, während die Schwimmer bestenfalls normale Knochendichte hatten oder sogar geringere, was sich durch fehlende Bodenreaktionskräfte gut begründen lässt. Für die Sportarten Radfahren, Walking und Krafttraining kann ausgesagt werden, dass niedere Intensitäten zu keinen oder geringen Adaptionen führen. Anders sieht es bei Sprungdisziplinen und hochintensivem Krafttraining aus, für die osteoanabole Reize nachgewiesen wurden, so dass etwa bei jungen Gewichthebern eine höhere Knochendichte vorhanden ist. Dabei zeigt sich ein etwa proportionaler Zuwachs des Knochens mit der Muskelkraft, andererseits scheint auch die Muskelmasse mit der Knochenmasse korreliert zu sein. Diese beiden Größen fallen bei älteren, inaktiven Menschen naturgemäß auseinander, weil die Nichtbenutzung der Muskulatur zu intramuskulären Verfettungen führt, so daß einer scheinbar passablen Muskelmasse eien deutlich geringere Kraft entgegensteht. Ähnliche Ergebnisse wie für Jüngere gelten für spätere Lebensjahre. In einer Studie mit Frauen ab 65 Jahren waren die Hälfte der Probandinnen nicht in der Lage ein Gewicht von 5 kg zu heben, was auf eine deutlich verminderte Muskelkraft und Muskelmasse schließen lässt, die für Osteopenie bekannterweise disponieren. Auch für Trainingsintensität und Knochenmasse ist ein Zusammenhang belegt. In Studien mit Trainingsprogrammen sind Muskelkraftzuwächse von bis zu 174% binnen 8 Wochen belegt. Das birgt die Gefahr, dass die zum Ausgangszeitpunkt minder robusten und vielleicht auch osteoporotisch veränderten Knochen der schnell anwachsenden Muskelkraft nicht standhalten, da der Zuwachs an Knochenmasse und -belastbarkeit wesentlich länger dauert als der der Muskelkraftzuwachs. Im Krafttraining wird davon ausgegangen, dass für den Erhalt der Knochenmasse 70% bis 80% des 1RM als Trainingsintensität notwendig sind, was ungefähr dem 10RM entspricht. Als K ochenmasse erhaltende Ausdauerbelastungen taugen vor allem solche mit hohen Bodenreaktionskräften, etwa Running. Der Trainingsumfang erweist sich als wesentlich weniger wichtig als die Trainingsintensität, hier zeigt sich relativ rasch ein abnehmender Grenznutzen. Übersteigt der Trainingsumfang ein gewisses Maß, so greifen negative Effekte für die Knochendichte, die hormonell bedingt abfällt. In puncto Trainingsfrequenz sind mindestens drei Einheiten pro Woche wünschenswert. Die Reize der mechanischen Belastungen werden etwa 48 Stunden in der Grundsubstanz gespeichert und wirken nach. Von der Vibrationstherapie bzw. den mutmaßlichen osteoanabolen Reizen von Vibrationen kann mittlerweile gesagt werden, dass diese nicht über die Wirkung hinausgeht, die die muskuläre Beanspruchung dabei erzeugt. Längere intensive statische Reize auf dem Knochen können die Osteoid-Synthese vermindern. Osteoanabole Reize sind immer regionär zu sehen, das heißt sie beziehen sich auf den Bereich, der belastet wird und nicht auf den gesamten Knochen. Auch wenn nur wenige Ergebnisse vorliegen, bei denen die Knochenmasse um mehr als zwei bis drei Prozent angestiegen ist, hat sich doch die Belastbarkeit des Knochens dabei um ein Viertel verbessert.
Die Prävalenz der Osteoporose postmenopausaler Frauen wird in den Lebensdekaden fünf und sechs mit etwa 15% angegeben, bei über 70-jährigen allerdings schon mit 45%. Dagegen liegen die Werte des männlichen Geschlechts bei 2,4% bzw. 17% und damit deutlich unter der Hälfte. Damit weisen postmenopausale Frauen in höherem Alter das höchste Frakturrisiko auf. Gerade zu Beginn der Pubertät ist der Körper sehr empfänglich für osteoanabole Reize, hier ist ein Knochenmassezuwachs und ein Zuwachs an Stabilität möglich, der in späteren Jahren ausgeschlossen ist. Bei diesem Effekt scheint sich einer Synergie aus hoher Osteoblastenaktivität und hohem Pegel an Wachstumshormonen abzuzeichnen. Vor allem die ersten fünf Jahre der Menopause scheinen kritisch zu sein, hier ist in Einzelfällen ein Knochenmasseverlust bis zu 15% möglich. Es gibt Hinweise darauf, dass in jedem Lebensalter ein gewisser Zuwachs an Knochenmasse möglich ist, wenn entsprechendes Training absolviert wird. Für das allgemeine Frakturrisiko werden primäre und sekundäre Ursachen angegeben. Abgesehen von der Anfangsphase des intensiven Krafttrainings des zuvor Untrainierten, in der schnell hohe Zuwächse an Muskelkraft erzielt werden können, dem der Zuwachs an Knochenmasse und -stabilität nicht standhalten kann, kann in späteren Zeiten sämtliche zur Verfügung stehende Kraft ausgereizt werden, da, insbesondere bei regelmäßigem Training, beide Zuwächse, nur durch das Time lag bei den Knochen verzögert, einhergehen. Vor allem in den Anfangszeiten sollte also auf hohe Bewegungsgeschwindigkeiten und Sprungdisziplinen verzichtet werden. Bei Patienten mit fraglicher Knochensubstanz erhält die Sturzprophylaxe eine große Bedeutung, da 90% der Hüftfraktoren und 50% der Wirbelsäulenfrakturen aus einem Sturz resultieren. Die davon Betroffenen erreichen häufig nicht wieder das ursprüngliche Aktivitätsniveau. Leider zeigt sich unter den Betroffenen mit 10% nur eine geringe Adhärenz zu institutionalisierten oder selbst durchgeführten Trainingsprogrammen.
Knochenadaption
Aus Experimenten ist bekannt, daß ein unbelasteter Knochen in der Schwerelosigkeit in den ersten 3 Monaten 25% seiner Masse verliert und in den nächsten 3 Monaten weitere 25% seiner ursprünglichen Masse. Eine konsequente Immobilisierung wie absolute Bettruhe hat ähnlich verheerende Wirkung auf den Knochen. Belastung des Knochens im Sinne von Zug, Druck, Torsion oder Biegung sind elementare Reize zum Erhalt des Knochens. Selbst medikamentös ist der sonst eintretende Knochenmasseschwund nicht aufzuhalten. Torsion erzeugt ringsum Zug, Biegung erzeugt auf der konvexen Seite Zug und auf der konkaven Seite Druck. Schon Wolf (1892, Wolf’s Law) postulierte, daß Knochen sich der Belastung anpassen, also bei unzureichender Belastung Masse abbauen und bei überschwelliger Belastung Masse aufbauen und an Dichte und Festigkeit zunehmen. Hierzu untersuchte er unter anderem die Trabekelstruktur des proximalen Femur und stellte fest, daß sich diese der Belastung anpasst. Frost postulierte 1960 im Utah Paradigm of Skeletal Physiology, daß sich Knochen lebenslang an die täglichen Belastung anpassen, indem sie auf die maximalen Verformungen reagieren. Knochenverformung wird in Microstrain µS gemessen, 1 Strain entspricht dabei einer Längenänderung von 100% der Knochenlänge, 1000 µS entsprechen also 0,1 % Verkürzung bei Druck bzw. Verlängerung bei Zug. Frost unterteilt in 4 Belastungszonen des gesunden Knochens und gibt an, wie der Knochen dabei reagiert:
- Disuse: die Zone unterhalb von 800 µS führt zu Abbau von Knochenmasse und -festigkeit
- Adapted State: die Zone von 800 – 1500 µS erhält den Knochen, es findet Umbau und Reparatur statt, aber weder Zunahme noch Abnahme von Masse und Festigkeit
- Overload: die Zone oberhalb etwa 1500 µS bis ca. 15000 µS führt zu Zunahme von Knochenmasse und Festigkeit
- Fracture: Belastungen oberhalb etwa 15000 µS führen zu Brüchen
Damit gehören Wolf und Frost zu den Vätern der Mechanobiologie, die die Änderungen der biologischen Gegebenheiten als Antowrt auf mechanische Reize zu beschreiben versucht, womit sie kein Teilgebiet der Biomechanik ist, die das Verhalten eines als fest gegeben betrachteten Systems zu beschreiben versucht. Frost hat als begriffliches Analogon zum technischen Thermostat, der den Wärmefluß in Abhängigkeit von der vorhandenen Wärme regelt, von einem Mechanostaten gesprochen, der die Belastbarkeit in Abhängigkeit von der vorliegenden Belastung regelt. Die typische maximale Verformung einer Tibia, wie sie in Alltag und Sport auftritt, liegt etwa bei 2000 µS (Mensch) – 3000 µS (Tierversuch) und damit eine gute halbe Zehnerpotenz unterhalb der Bruchschwelle. Alltägliche Belastungen außerhalb des Sports und schwerer körperlicher Arbeiten halten sich oft im Rahmen von nur 10 µS, was für den Knochenerhalt völlig unzureichend ist. Belastungen von 1000 µS und mehr sind sehr selten. Ab Verformungen von etwa 4000 µS baut der Knochen provisorisch mechanisch minderwertigen Faserknochen auf, den er danach zu stabilem Lamellenknochen umbaut. Wird er dabei jedoch wiederholt gestört, weil die zur Verfügung stehenden Regenerationszeit zu gering ist, kann es zum Ermüdungsbruch kommen. Die Bruchgrenze von etwa 15000 µS kann beim gesunden Knochen auch durch kräftigsten explosiven Einsatz von Muskulatur bei weitem nicht erreicht werden, dazu sind externe Kräfte notwendig.
Die obigen Betrachtungen gelten nur für Zug und Druck, bei der etwa die Tibia das 50-60 -Fache des Körpergewichts aushält. Die maximale Biegelast senkrecht zur Längsachse liegt jedoch um eine Zehnerpotenz darunter. Darüber hinaus gelten nicht für alle Knochen die gleichen Werte. Der Schädelknochen etwa hat eine 6-8 -mal niedrigere Remodeling-Schwelle, also etwa 200 – 250 µS statt 1500 µS, das heißt, er reagiert wesentlich früher auf Reize bzw. Notwendigkeiten und schafft damit größere Sicherheit durch viel raschere Anpassung. Als knochenmassevermehrende Reize kommen nur überschwellige Reize in Frage. Dabei ist die Höhe der wichtigere Faktor gegenüber der Anzahl: beide Parameter verhalten sich weitgehend linear bis zur Schwelle von 4000 µS, jedoch verläuft die Funktion für die Höhe der Reize steiler als die für die Anzahl. Daraus resultiert auch etwa, daß Gewichtheber im Schnitt eine 20% – 30% höhere Knochenmasse haben wie ähnlich gut trainierte Marathonläufer. Einmalige hohe Verformungslasten wirken nicht osteoanabol, nur wiederholte. Dieses Modell bezieht sich nur auf die reine Höhe und Anzahl der Verformungen. In Wirklichkeit ist auch die Beschleunigung bei der Verformung relevant, es führt also eine rascher eintretende Verformung zu einer höheren Adaption als eine langsamere gleich hohe. Wird der Knochen mit 1,1 g beschleunigt, hat dies bereits einen positiven Einfluß auf die kortikale Dicke, ab 2,5 g wächst der Umfang des Knochens, ab 3,9 g, die sich bei schnellem Laufen und in Spurungdisziplinen erreichen lassen, steigt auch die Knochendichte, ab 5,4 g der kortikale Querschnitt.
Das Hormon Östrogen scheint eine antiosteoanabole Wirkung zu haben, wie bei jungen, präpubertale Tennisspielerinnen gezeigt werden konnte, deren Knochenmasse durch vergleichbares Training mehr zunahm als bei solchen in der Pubertät oder danach. Im Tierversuch (ovariektomierte Ratten) zeigte sich ebenfalls, daß verabreichtes Östrogen antiosteoanabol wirkt, den Knochenabbau aber auch hemmt. Es senkt auch die Schwelle zur minimalen effektiven Belastung in der Kortikalis und der Trabekelstruktur, nicht aber im Periost. Männliche Ratten mit Östrogengabe bauten bei osteoanabol ausgelegtem Training 43% weniger Knochenmasse auf. Es wird vermutet, daß der postmenopausale Östrogenmangel zu einer verminderten osteoanabolen Wirkung von grundsätzlich osteoanabolen Trainingsreizen führt. Es zeigt sich, daß sich beide Geschlechter verschieden auf Östrogengaben reagieren: während bei weiblichen Mäusen der ER-alpha-Rezeptor wichtig für die osteoanabole Wirkung war und der ER-beta-Rezeptor sie eher hemmt, ließ die knochenaufbauende Wirkung bei männlichen Mäusen unter Östrogengabe nach.
Für die Knochenadaption geht man von einem Regelkreis aus, bei dem Osteozyten als Mechanosensoren fungieren, die bei Bedarf im Sinne von Überlastung Osteoblasten aktivieren und Ostoklasten hemmen, was so lange geschieht, bis die Osteozyten keine Überlastung mehr detektieren. Zusammen mit der regulären Tätigkeit der Osteoklasten und Osteoblasten entsteht so ein adaptierendes Fließgleichgewicht. Als Referenz für die Biegebelastungen, denen ein Knochen regelmäßig ausgesetzt ist, hat sich die Dicke der begleitenden Muskulatur bewährt, da die Dicke über die Fähigkeit des Muskels zur Adaption an Belastung mittels Hypertrohie oder Atrophie ein alltagstaugliches Korrelat zur Maximalkraft darstellt. Im Falle pathologisch veränderter Knochen, wie etwa bei Osteoporose, ist die Bruchschwelle teils deutlich herabgesetzt und unbekannt. Hier ist also geraten, therapeutisch mit weniger hohen Reizen zu arbeiten, um das Risiko einer Fraktur möglichst gering zu halten, dafür aber mit mehr Wiederholungen. Hier hat sich die Vibrationstherapie bewährt.
In der Praxis muß unterschieden werden in solche Bewegungen, die vor allem schwerkraftinduzierten axialen Druck auf die Knochen erzeugen, wie es beim Gehen und Laufen der Fall ist, und solchen, die vor allem Biegemomente aus eingesetzter Muskelkraft erzeugen. Grundsätzlich können beide Gruppen hinreichend osteoanabol wirken. Wo die Intensität nicht hinreicht, kann oft mit Iteration ausgeglichen werden. In der zweiten Gruppe zeichnet Krafttraining sich durch eine gute Wirkung bei einer Vielzahl positiver Begleiteffekte wie begleitende, sehr effektive Kräftigung der Muskeln und ihrer Sehnen, Ausschüttung von Myokinen und einem (bei korrekter Ausführung) sehr geringen Nebenwirkungsspektrum aus. Die Ausdauersportarten Schwimmen und Radfahren liefern kaum axiale Lasten und unzureichende Biege- und Torsionsmomente, so daß Studien keine osteoanabole Wirkung nachweisen konnten, ganz im Gegensatz zum Laufen (Running). Die in die erste Gruppe fallenden Tanz- und Sprungdisziplinen konnten ebenfalls eine hinreichende Wirkung erzielen, jedoch muß man mit einer Empfehlung vorsichtig sein aufgrund des möglichen Nebenwirkungsspektrums und den zugeordneten Wahrscheinlichkeiten im Bereich der Gelenke. So kann sich hinreichendes Tanztraining durchaus als ruinös für etwa die Kniegelenke erweisen, Sprungdisziplinen betreffen oft nicht und die Gelenke, sondern bergen auf Gefahren für die Muskulatur (Zerrungen, Risse) und die Sehnen (Insertionstendopathien).
Studien geben für Gehen einen Impact in Höhe des 1,5-fachen des Körpergewichts an, was als Erhaltungsreiz kaum ausreicht.
Laufen steht mit etwa dem 2,5-fachen deutlich besser da, ist aber noch nicht so osteoanabol, daß Knochenmasse oder -dichte aufgebaut würde.
Sprünge hingegen werden mit dem etwa 4-fachen des Körpergewichts als studienabgesichert osteoanabol angegeben,
wobei die genaue Höhe des Reizes natürlich von der Sprunghöhe und der Frage abhängt od einbeinig oder zweibeinig gelandet wird.
Dabei sollte einige wenige dutzend Sprünge bereits ausreichen, ein wesentlich höheres Maß können bereits Nebenwirkungen an anderer Stelle zeitigen.
Wassergymnastik dürfte seine Wirksamkeit wegen iterierter Bewegung gegen den Wasserwiderstand aufweisen, der in der Kinetik in den Extremitäten mit der Geschwindigkeit über die Entfernung von dem Gelenk am Rumpf zunimmt und daher zu signifikanten Biegemomenten führen kann. Jedoch können auch hier hohe Trainingsvolumina je nach Bewegung zu Varus– und Valgusmomenten führen, die Menisken oder Kollateralbänder belasten.
Tai Chi dürfte seine Wirksamkeit vor allem in der unteren Extremität wegen wechselnder Bewegungen mit gebeugten Kniegelenken und der Notwendigkeit dynamischer Stabilisierung des Standes haben. Auch hier muß bedacht werden, daß zu einigen Bewegungsfolgen Drehungen des Körpers auf stehendem Fuß bei gebeugten Kniegelenken gehören, was nennenswerte Scherkräfte in den Menisken erzeugt. Auch nicht achsengerechte Beugungen der Kniegelenke, also solche, bei denen Rotationen im Kniegelenk während des Streckens oder Beugens stattfinden, sind im Tai Chi zu sehen.
Allen Trainingsformen dürfte jedoch gemein sein, daß ein einmaliges Training pro Woche gerade einmal zum Erhalt der Knochenmasse ausreicht. Für eine osteoanabole Wirkung ist mindestens zweimaliges Training pro Woche erforderlich.
Die Festigkeit eines Knochens resultiert zu 60% aus seiner Knochenmineraldichte und zu 40% aus weiteren Faktoren wie Querschnitt, Trabekelarchitektur, Knochenqualität und Funktionsfähigkeit der Osteozyten.
Im Vergleich zu trockenem Holz gleichen Durchmessers liegt die Bruchlast bei Verbiegung beim Knochen dreimal so hoch und immer noch halb so hoch wie bei Stahl.
Vor Abschluß des Wachstums des Menschen unterliegt das Knochenwachstum einem circadianen Rhythmus mit dem Maximum in der Nacht. Dabei können aus noch nicht geklärten Gründen Wachstumsschmerzen auftreten. Das Wachstum findet in den Epiphysenfugen statt, die mit Abschluß der Wachstumsphase gegen dem 18. Lj. verknöchern. Der permanente Knochenumbau (darin auch die Erneuerung) wird als Knochengeweberemodellierung bezeichnet.
Die meisten Knochen entwickeln sich aus dem hyalinem Knorpelskelett (chondrale Ossifikation), nur die Schädelknochen aus bindegewebigen Vorstufen (desmale Ossifikation).
osteoanabol
Als osteoanabol werden Reize oder Substanzen bezeichnet, die dem Knochenaufbau dienen, siehe obige Herleitung.
Condylus
Condylen, auch als Gelenkfortsatz oder Gelenkknorren bezeichnet, sind die am Ende von Knochen liegenden Verdickungen, die die Atrikulationsflächen mit anderen Knochen enthalten.
Zuweilen liegen auf den Condylen Epicondylen, das sind Knochenvorsprünge, an denen Muskeln bzw. deren Sehnen ansetzen.
Die bekanntesten Condylen sind die des distalen Humerus (im Ellbogengelenk), der proximalen Tibia und des distalen Femur (beide im Kniegelenk).
Epicondylus
Knochenvorsprünge auf Condylen, an denen Muskeln bzw. deren Sehnen ansetzen.
Tuberkel
Höcker auf Knochen, an denen Muskeln bzw. ihre Sehnen ansetzen, z. B. Tuberculum minus und Tuberculum majus des Humerus.
Apophyse
Knochenansätze von Sehnen und Bändern mit eigenem Ossifikationszentrum, das meist mit dem Hauptkern der Epiphyse verschmilzt. Gelegentlich bleibt es aber auch eigenständig. Hier ansetzende Sehnen sind über Faserknorpel mit dem Knochen verbunden, der zunehmend mineralisiert. Die Knorpel bieten dabei eine gewisse Elastizität. Die Apophysen an den Muskelinsertionen des Rectus femoris, der Adduktoren und der Ischiocruralen Gruppe sind zuweilen von Schäden betroffen. Das reicht von geringfügigen Veränderungen bis zu knöchernen Ausriss der Sehnen (Avulsion). Entsprechend der betroffenen Muskulatur liegt häufig eine Schmerzausstrahlung vor in Richtung Leiste oder des Gesäßes. Radiologisch sind diese Störungen gut zu finden, jedoch zeigt sich ihr Bild recht uneinheitlich. Differentialdiagnostisch müssen osteolytische Prozesse und Tumoren abgeklärt werden.
Diaphyse
Der Bereich eines Röhrenknochens zwischen den Wachstumsfugen. In diesem befindet sich das Knochenmark. Hier ansetzende Sehnen setzen über Sharpey-Fasern am Knochen an, die eine Dämpfung durch die Verflechtung der Kollagenfasern der Sehne mit elastischen Fasern der Knochenhaut bieten.
Epiphyse / Epiphysis ossis
das knorpelig angelegte Ende eines Röhrenknochen, in dem sich während des Wachstums Knochenkerne entwickeln, die den Knochen wachsen lassen. Die Epiphyse ist durch die Epiphysenfuge (Wachstumsfuge) von der Diaphyse getrennt, in der sich das Knochenmark befindet. In Bezug auf die Körpermitte wird von einer proximalen und einer distalen Epiphyse gesprochen. Ist die Epiphyse Teil eines Gelenks (anders als die proximale Epiphyse der distalen Phalangen von Zehen und Fingern), so ist die im Bereich der Artikulation mit hyalinem Knorpel (Gelenkknorpel) überzogen.
Epiphysenfuge / Wachstumsfuge
der knorpelige Übergangsbereich von der Epiphyse eines Röhrenknochens zur Metaphyse, in dem sich während des Wachstums Knochenkerne entwickeln, die den Knochen wachsen lassen. Mit etwa 20 Jahren ist das Längenwachstum abgeschlossen, das von den Epiphysenfugen ausgeht. Dazu verringert sich der STH-Spiegel, und die Epiphysenfugen verknöchern.
Metaphyse
Die beiden (proxmimal und distal) Bereiche des Schafts eines Röhrenknochens, in dem noch kein Knochenmark vorhanden ist.
Knochenhaut (Periost)
Bindegewebige Umhüllung der Knochen, die ihn außerhalb der mit hyalinem Knorpel überzogenen Glenkflächen vollständig umgibt. Im Bereich des Schädels wird sie auch als Pericranium bezeichnet. Das Periost gehört zu den schmerzempfindlichsten Geweben des Körpers, weshalb traumatisch entstandene Ödeme unter der Knochenhaut mit deutlichem Schmerzempfinden verbunden sind. Es hilft bei Ernährung und Regeneration des Knochens. Die innere (profundere) Schicht des Periost, das Stratum osteogenicum (Kambium) enthält Knochenvorläuferzellen, die sich zu Osteoblasten differenzieren können, was dem Dickenwachstum des Knochens dient, aber auch wichtig ist für die Heilung des Knochens nach Brüchen. Außerdem enthält sie Blutgefäße und Nerven. Die äußere Schicht, das Stratum fibrosum, ist zellarmes, kollagenreiches Bindegewebe, von dem aus die Sharpey-Fasern durch das Stratum osteogenicum, um das Periost in der
Corticalis zu verankern. Vor allem bei Sehnenansätzen an Diaphysen von Röhrenknochen setzen diese als Kollagenfasern im Stratum fibrosum an.
Spongiosa
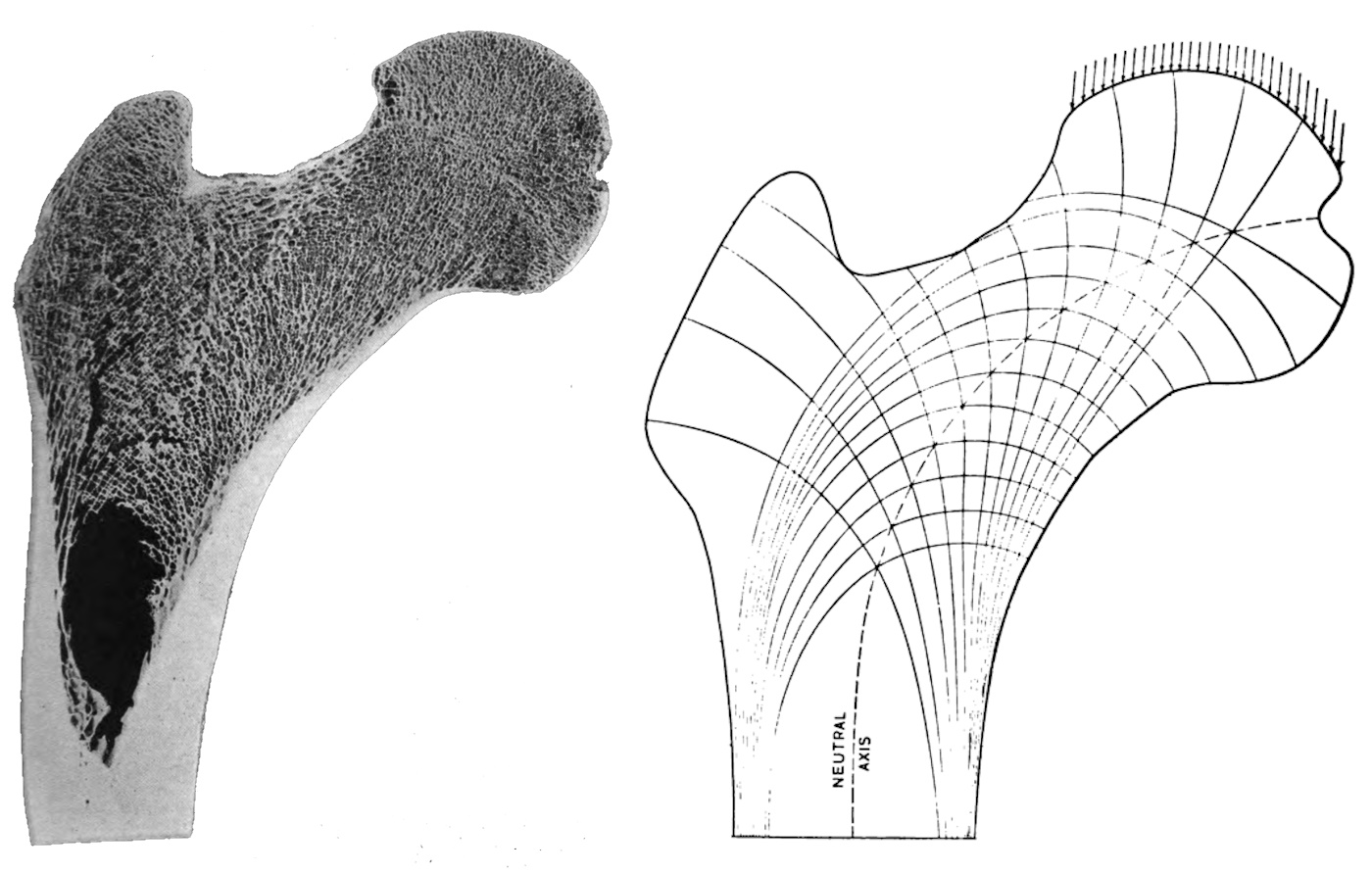
Im Inneren vieler Knochen liegendes schwammartig aufgespanntes Knochengewebe von großer Festigkeit bei vergleichbar geringer Masse. Der Zwischenraum zwischen den Trabekeln (Knochenbälkchen) der Spongiosa ist mit Knochenmark gefüllt. Die Trabekelstruktur kann sich mit der Belastung des Knochens nach Ausrichtung und Gesamtmasse verändern, siehe Knochenadaption. Sie ist überwiegend ausgerichtet nach den Hauptbelastungsrichtungen in der Vergangenheit. Diese wichtigsten Kraftflußlinien werden als Trajektorien bezeichnet. Deswegen unterscheidet sich die Trabekelstruktur je nach Knochen und Lage sowie Beanspruchung (Druck, Torsion oder Biegung). Die Wirbelkörper etwa sid hauptsächlich Druck ausgesetzt, der Femurkopf hingegen auch stark Biegung und nachrangig Torsion. Die Struktur der Trabekel orientiert In platten Knochen wird die Spongiosa als Diploë bezeichnet, die darin enthaltenen Venen als Venae diploicae.
Corticalis
Die Corticalis ist die Knochenschicht unterhalb des Periost. In der Diaphyse (Schaft) der Röhrenknochen ist sie sehr dick, da dort die Spongiosa fehlt. Hier wird sie als Kompakta bezeichnet.
Röhrenknochen
In der Regel länglicher Knochen mit zwei Enden (Epiphysen) und einem halbwegs zylindrischen Schaft (Diaphyse), in dem sich Knochenmark befindet. Die Epiphysen an beiden Enden des Röhrenknochens sind durch die Wachstumszone (Epiphysenfuge) mit der Diaphyse verbunden. Nach Abschluß des Wachstums sind die Epiphysenfugen dann geschlossen. Apophysen dienen der Ausprägung von Insertionen von Bändern und Sehnen.
Trabekel
Trabekel (Knochenbälkchen) sind ein makroskopisch sichtbares strukturiertes, schwammartiges Netzwerk von Knochengewebe in der Spongiosa , das sich hauptsächlich in der Richtung ausrichtet, in der der Knochen am stärksten belastet wird, sie folgenden den Trajektorien (virtuelle Linien maximalen Kraftflusses). Gegenüber einer soliden
Corticalis spart dies Masse und Gewicht ein, ermöglicht aber auch die Anpassung an veränderte Belastungen. An Stellen mit höherer Last verdichtet sich die Trabekelstruktur. Die Trabekelstruktur unterscheidet sich daher in Knochen, die vor allem Druckbelastungen ausgesetzt sind wie die Tibia, und solchen, in denen Biegebelastungen oder Torsionen auftreten, wie etwa am Übergang des Femurschafts zum Kopf. Microverletzungen werden von Osteoklasten abgebaut und von Osteoblasten wieder aufgebaut. In Röhrenknochen fehlt die Spongiosa auf Höhe der Markhöhle, stattdessen ist die Corticalis dort dicker ausgeprägt. Die Remodeling-Prozesse der beiden Knochenanteile unterscheiden sich. Da die Spongiosa ein etwa um den Faktor 10 schnelleres Turnover aufweist, werden pathologische Prozesse wie
Osteoporose dort zuerst und vor allem sichtbar. Dort, wo die Trabekslstruktur hohe Biegelasten auffangen muß, entstehen dann bevorzugt Brüche. Die Tatsche, daß die Trabekel keine Gefäße besitzen sondern per Diffusion aus den Gefäßen des Knochenmarks versorgt werden, begrenzt die Dicke der Trabekel auf rund 300 µm.
Knochenmark
Im Zentrum größerer Knochen liegendes Binde- und Stammzellgewebe, das Blutzellen bildet. Es befindet sich in der großen Markhöhle im Inneren der Diaphyse der Röhrenknochen, aber auch in den Zwischenräumen der Trabekelstruktur. Es wird unterschieden in rotes Knochenmark (Medulla ossium rubra), das Blutzellen bildet und gelbes Knochenmark (Medulla ossium flava), welches Fett speichert, aber keine pluripotenten Stammzellen mehr enthält um Blutzellen zu bilden. Beim Erwachsenen beträgt das rote Knochenmark rund 400 g, von denen je etwa 180 g Erythrozyten und Leukozyten bildt, die übrigen etwa 40 g bilden Thrombozyten. Beim Säugling findet sich in allem Knochen rotes Knochenmark, mit zunehmendem Alter wird dies aber im Schaft der langen Röhrenknochen durch gelbes ersetzt. Nur wo noch rotes Mark vorhanden ist, kann sich dieses evtl. ausdehnen. Auch das rote Knochenmark enthält einen gewissen Anteil Fett, ca. 35% in den Wirbelkörpern und ca 75 % in den Rippenknochen. Neben rotem und gelbem Mark gibt es noch gallertartiges weißes Mark, bei dem Fett durch Wasser ersetzt ist. Dieses kann ebenfalls nicht mehr zu rotem Mark umgewandelt werden. Weißes Mark kommt vor allem in hohem Alter und bei Schwerkranken vor. Ausganspunkt der Blutzellenbildung ist der Hämozytoblast, der sich in einen weiteren Hämozytoblasten und eine Vorläuferzelle von Erythrozyten, Leukozyten oder Thrombozyten teilt.
Markhöhle /Markraum
Die Markhöhle ist der große Knochenmark-haltige Innenraum von Knochen, der von Endost ausgekleidet im Inneren der Corticalis liegt. Die Markhöhle wird von Arterien versorgt, die durch kleine Löcher (Foramina nutricia) in der Knochensubstanz verlaufen. Beim jungen Menschen enthält die Markhöhle noch rotes Knochenmark, beim Erwachsenen nur noch gelbes Knochenmark.
Osteoklasten
Osteoklasten sind mehrkernige Riesenzellen, die dem Abbau von Knochen dienen. Sie entstehen aus monozytären Stammzellinien. Ihre Tätigkeit bildet die Howship-Lakunen an den Oberflächen der Trabekel, dies sind Zentren der Knochenresorbtion und Ausgangspunkte des Wiederaufbaus.
Osteoblasten
aus weniger differenzierten Vorläuferzellen entstehende Zellen, die die noch nicht mineralisierte Grundsubstand des Knochens bilden. Sie produzieren die alkalische Phosphatase, die die Mineralisierung des Knochens steuert. Aus Osteoblasten entstehen Osteozyten.
Osteozyten
reife Knochenzellen, die aus Osteoblasten entstehen, wenn sich diese in die von ihnen gebildete Knochenmatrix eingeschlossen haben. Osteozyten kommunizieren über die Zelfortsätze miteinander und dienen sowohl der Erhaltung der Knochenmatrix als auch der Calciumhomöostase. Außerdem sind sie mechanosensitiv und können Osteoblasten anregen und Osteoklasten hemmen, wenn die Knochenmasse zwecks Erhöhung der Stabilität vermehrt werden muß.
Knochendichte
Unter Knochendichte wird der Gehalt an Mineralien, hauptsächlich Calcium in einem Knochen verstanden, oft auch als Verhältnis mineralisierter Substand zur Gesamtsubstanz formuliert. Eine niedrige Knochendichte führt zu verminderter Festigkeit und erhöhter Bruchanfälligkeit. Das übliche Verfahren zur Bestimmung ist die DXA (DEXA, Dual-Energy X-ray Absorptiometry) oder Osteodensitometrie, ein low dose Röntgen-Verfahren mit zwei Röntgenstrahlen unterschiedlicher Energie (z.B. 40 keV und 70 keV), das die Körperzusammensetzung (Body Comp) ermitttelt. Bei Schwangeren, Kindern und Jugendlichen sollte das Verfahren wegen der Strahlenbelastung von etwa 5–7 µSv nicht angewendet werden. Die Knochendichte erreich meist zwischen dem 25. und 30. Lebensjahr ihr Maximum (peak bone mass). welches bei Männern um etwa 30% höher liegt als bei Frauen. Wenn die Knochendichte unterhalb einer Standardabweichung vom Mittelgesunder Menschen gleichen Geschlechts und Alters liegt, spricht man von einer Osteopenie, unterhalb von 2.5 Standardabweichungen von einer Osteoporose.
Kallus
Bei einer sekundären (indirekten) Frakturheilung, bei der die Frakturstücke nicht exakt aufeinanderpassen und ineinander greifen, bilden die Osteoblasten eine Überbrückung, die radiologisch als Verdickung des Knochenstücks um die Fraktur sichtbar ist. Der Kallus ist das Narbengewebe des Knochens. Etwa ab der 7. Woche startet die Verknöcherung durch zunehmende Calcium-Einlagerung, und etwa nach 25 Wochen ist der Knochen geheilt. Bei einer direkten (primären) Frakturheilung mit bis zu 1 mm Abstand der Knochenstücke findet keine Kallusbildung statt, da der Knochen durch die Havers-Kanäle heilt, die zentrale Grundeinheit eines Osteons in der Compacta. Zur Knochenheilung siehe unter Bruch.
Frakturheilung
Es gibt zwei Mechanismen der Frakturheilung:
direkte (primäre Frakturheilung)
ist das Periost intakt geblieben, oder sind die Bruchenden noch verbunden, findet eine primäre Frakturheilung statt. Sind die Bruchenden weniger als 1 mm voneinander entfernt, wächst kapillarreichens Bindegewebe in den Bruchspalt ein, eine sichtbare Bildung von Kallus um die Bruchstelle herum findet nicht statt. Es sammeln sich Vorläuferzellen der Osteoblasten (Osteoprogenitorzellen) aus Periost und Endost um die vorhandenen Kapillaren an und bilden zuerst noch parallel zur Bruchfläche angeordnete Osteone. Diese werden später in Richtung parallel zur Längsachse des Knochens umstrukturiert durch Erosionstunnel. Nach drei Wochen liegt wieder ein funktionsfähiger Knochen vor.
indirekte (sekundäre Frakturheilung)
Waren die obigen Bedingungen nicht erfüllt, war also etwa der Spalt größer als 1 mm, muß der Knochen, beginnend mit Kallusbildung (intern und extern) in einer fünfstufigen Procedere repariert werden:
- Verletzungsphase mit Entstehung eines Hämatoms im Gelenkspalt
- Entzündungsphase mit Einwanderung von Makrophagen, Granulozyten und Mastzellen; Freisetzung von Histamin und Heparin. Mesenchymale pluripotente Stammzellen differenzieren zu Osteoblasten, Fibroblasten und Chondroblasten. Zytokine und Wachstumsfaktoren wirken steuernd für Zelldifferenzierung und Angioneogenese.
- Granulationsphase (4.-6. Woche): das mittlerweile mit Fibrin und Kollagen gebildete Netz in dem Hämatom wird durch Granulationsgewebe mit Fibroblasten, weiterem Kollagen und Kapillarisierung ersetzt. Nicht durchblutetes Knochenmaterial wird von Osteoklasten abgebaut, neues Knochenmaterial wird von Osteoblasten vom Periost aus aufgebaut.
- Kallushärtung (Dauer: 3-4 Wochen): der entstandene Kallus wird mineralisiert, was zu einem bzgl. des Kollagens noch ungerichteten Geflechtknochen führt. Die Kapillaren und die Grobstruktur des Knochens entsprechen schon der physiologischen Flußrichtung und Hauptbelastungsrichtung
- Umbauphase: Modeling und Remodeling: der Geflechtknochen wird in physiologischen Lamellenknochen mit Haverskanälen und Volkmannkanälen ungebaut.Der Markraum wird wiederhergestellt. Die komplette Heilung sollte damit nach 6 – 24 Monaten abgeschlossen sein.
Wird die Frakturheilung gestört, kann eine Pseudoarthrose entstehen, also eine nicht hinreichend gehärtete und remodelierte Bruchstelle, von minderer Stabilität (Non-Union). Bleibt die Frakturheilung hinter dem Zeitrahmen zurück (verzögerte Frakturheilung), so muß geprüft werden, ob die Immobilisierung hinreichend war oder verbessert werden muß. Wurden die Frakturstücke nicht korrekt reponiert, resultiert eine Frakturheilung in Fehlstellung (Mal-Union), dabei können die Längsachsen der beiden (Haupt-)Knochenstücke ungleich sein oder ein Knochenstück gegenüber dem anderen um die Längsachse verdreht. Geschieht eine Mal-Union an einem Knochenende durch die artikulierende Fläche hindurch, kann eine Inkongruenz resultieren. Außerdem kann eine Frakturheilung für längere Zeit fibrös bleiben. Das fibröse Gewebe wird meist nach einer Zeit durch Knochengewebe ersetzt.
Osteolyse
Osteolyse ist der aktive Abbau von Knochengebewe, sei es physiologisch im Rahmen der ständigen Knochenerneuerung oder wegen fehlender Erhaltungsreize (über 800 µS) oder pathologisch im Rahmen von Erkrankungen. Diese umfassen:
- Stoffwechselstörungen des Knochens wie Osteopenie, Osteoporose, Osteomalazie und Hyper-PTH
- Knochenzysten und primäre Knochentumoren (wie z.B. Osteosarkom, Ewing-Sarkom), Knochenmetastasen oder hämatologische Neoplasien wie dem Plasmozytom
- Entzündungen (infektios oder aseptisch) wie Arthritis, Osteomyelitis, RA, Parodontitis des Kieferknochens
- Implantat-Lockerung (durch Abrieb von Endoprothesen oder Osteosynthese-Material), auch im Kieferknochen bei Periimplantitis sowie durch Zahnverlust
- Amyloidose
Traktionsapophysitis
Die Traktionsapophysitis ist eine Stressläsion im Bereich zwischen einer
Apophyse und ihrem Knochen in der Jugend. Sie betrifft überwiegend junge Athleten und ist regelmäßig ein Overuse-Syndrom. Sie zählt zu den aseptischen Knochennekrosen.
In Phasen raschen Wachstums ist die Apophyse durch eine erhöhte Somatotropin-Produktion weniger stabil. Die relative Verkürzung der sich beim Wachstum nur mit Verzögerung anpassenden Muskulatur führt ebenfalls zu erhöhtem Zug an den Apophysen. Die mit der Pubertät einsetzende Hormonproduktion führt zu vergleichsweise rasch anwachsender Muskelkraft, was die Apophysen ebenfalls mehr belastet als vor der Pubertät. Diese drei Faktoren machen sie anfällig für Overuse wie auch für Traumata. Daher sind vor allem sportliche Kinder im Wachstumsschub gefährdet. Mädchen sind beim Morbus Osgood-Schlatter am häufigsten zwischen dem 10. und 11. Lebensjahr betroffen, Jungen wegen der später einsetzenden Pubertät zwischen 13 und 14. Beim Morbus Sinding-Larsen-Johansson sind beide Geschlechter im Schnitt 2 Jahre jünger. Beim Morbus Sever (Apophysitis des Calcaneus an der Achillessehnen–Insertion) liegt der Gipfel bei 8-12 Jahren.
Die bekanntesten Traktionsapophysitiden sind Morbus Osgood-Schlatter und Morbus Sinding-Larsen-Johansson. Morbus Iselin (Traktionsapophysitis des 5. Metatarsalknochens) und der Little league elbow (medial epicondyle apophysitis) am Epicondylus medialis humeri gehören auch dazu, nicht aber die Little league shoulder, da es sich dabei um keine Apophysitis handelt, sondern um eine Epiphysiolysis.
Neben der Traktionsapophysitis kommen an einigen Apophysen bei entsprechenden Auslösern auch Apophysenausrisse, also Avulsionen vor, etwa:
- SIAS: Sprint, Absprung, Tritt ins Leere
- SIAI: explosive Hüftflexion wie beim Schuß mit dem Fußspann, oder im Schuß extern blockierter Fuß (Boden, Gegner), hier kann bei übermäßiger Kallusbildung ein Impingement auftreten
- Tuber ischiadicum: ruckartige weite Hüftflexion bei mehr oder weniger gestrecktem Kniegelenk (DD: Zerrung der Ischiocruralen Gruppe, PHT)
- Crista iliaca (selten): ruckartige Flexion/Rotation des Oberkörpers
- Trochanter minor: ruckartige exzentrische Bewegung des Iliopsoas
Epiphysiolysis
Die Epiphysiolyse ist eine traumatische oder spontane Beschädigung der Epiphysenfuge mit teilweiser oder vollständiger Ablösung der Epiphyse vom Knochen. Dabei kommt es oft zur Translation der beiden Knochenanteile. Epiphysiolysen werden in Grade eingeteilt nach Aitken (Grad 0 – 4) oder nach Salter-Harris (Grad 1 bis 4). Beide Einteilungen entsprechen sich im Sinne aufsteigender Kardinalzahlen. Epiphysiolysen können nur vor Abschluß der Wachstumsphase auftreten. Ist die Epiphysenfuge bereits teilweise geschlossen (verknöchert), handelt es sich bereits um eine Fraktur. Die bekannteste Epiphysiolysis dürfte die Epiphysolysis capitis femoris sein, die einen orthopädischen Notfall darstellt und eine sofortige OP indiziert. Die Epiphysiolyse der Schulter (proximaler Humerus) geht oft auf ein Geburtstrauma zurück, sonst auf sportlichen Overuse. Junge Gymnasten neigen zur Epiphysiolysis radii distalis (Gymnast’s wrist, Distal Radial Physeal Stress Syndrome).
aseptische Knochennekrose
aseptische Knochennekrosen sind Osteonekrosen, die nicht auf ein Infektionsgeschehen zurückgehen. Der Pathomechanismus ist derzeit noch nicht geklärt, unklare Faktoren führen zum Verschluß eines zuführenden Gefäßes (Ischämie). Die vermutlichen Ursachen lassen sich gruppieren:
- genetische/konstitutionelle Faktoren
- Traumata oder iterierte Mikrotraumata
- vaskuläre Faktoren
- Ernährung, Medikamente, andere iatrogene Faktoren
Es sind viele einzelne Risikofaktoren bekannt:
- endokrine Gründe
- iatrogen: Chemotherapie, Thermotherapie, Bisphosphonate, Immunsuppression, Kortison
- Mangelernährung
- chronischer Alkoholabusus
- Mangelernährung
- SLE
- RA
- Sichelzellanämie
- längerer Aufenthalt in Umgebungen mit künstlich erhöhtem Luftdruck wie im Bergbau
Sowohl in der oberen als auch in der unteren Extremität können sie Osteonekrosen an verschiedenen Stellen auftreten, die meisten dieser Stellen haben mittlerweile eigene Bezeichnungen.
Die bekanntesten dürften sein:
- Morbus Osgood-Schlatter
- Morbus Sinding-Larsen-Johansson
- Morbus Scheuermann (wird heute nicht mehr zu den Osteonekrosen gezählt)
- Morbus Perthes
- Morbus Ahlbäck
- Morbus Blount
- Osteochondrosis dissecans (Sonderfall, weil sie sich subchondral, also am Übergang des Knochens zu seinem Knorpelüberzug abspielt)
Die Osteonekrose wird in 4 Stadien eingeteilt:
- Initialstadium: im Röntgen sind keine Veränderungen zu sehen, nur im MRT, z.B. ein Bone Bruise oder Knochenmarködem
- Osteopenie, die im Röntgen aus vermehrte Strahlentransparenz sichtbar wird. In der MRT ist eine Osteolyse zu erkennen, ggf mit umgebendem Knochenmarködem oder Mikrofrakturen
- im Röntgen wird eine Sklerosierung der Umgebung der Osteonekrose sichtbar, in der MRT der Sklerosierungssaum
- Auftreten sekundärer Defekte wie Fehlstellungen oder Gelenkflächendefekte, Arthrosen
Exostose
Die Exostose ist eine Knochenwucherung der Compacta, z.B. als gutartiger Knochentumor oder Osteom. Sie kann reizbedingt sein, also etwa durch wiederholten lokalen Druck verursacht, man spricht dann auch von einem knöchernen Überbein (Ganglion).
Osteophyt
Knochenmassevermehrung, meist im Rahmen von Arthrosen ab Grad 2. Die arthrotische Knorpelveränderung führt zu Inkongruenzen der Gelenkflächen und lokalen Druckerhöhungen, diese zu subchondralen Sklerosen und darüber zu lokalen Knorpel- und Knochennekrosen (Geröllzysten). Dieses Material sammelt sich am Rand der Gelenkflächen an und verkalkt zu Osteophyten, was wörtlich Knochenpflänzchen bedeutet. Sie sind in Sono und Röntgen nachweisbar und gelten als Zeichen einer fortgeschrittenen Arthrose. Durch lokalen Druck auf Nerven oder andere Weichteile (Sehnen, Bänder) können sie Folgeschäden verursachen. Brechen sie ab, können sie als freie Gelenkkörper ebenfalls zu weiteren Störungen führen, z.B. Einklemmungen.
